Отличие процесса транскрипции у про- и эукариот
РН-полимераза прокариот обеспечивает транскрипцию генов, несущих информацию о последовательностях молекул РНК всех трех классов: рибосомной РНК (рРНК), транспорт-ной РНК (тРНК) и информационной (или матричной) РНК (мРНК).
В эукариотических клетках имеются три различные РНК-по-лимеразы, каждая из которых специфически узнает промоторы, контролирующие транскрипцию трех различных классов молекул РНК. РНК-полимераза I локализуется в ядрышке и синтезирует основные рибосомные РНК. РНК-полимераза III осуществляет транскрипцию транспортных РНК и одного ком-понента рибосом — 5SPHK. Транскрипция молекул мРНК, не-сущих информацию о структуре белков, осуществляется РНК-полимеразой II. Ферменты II и III типа локализуются в нуклеоплазме.
Процессы образования мРНК в прокариотических и эукариотических клетках характеризуются существенными различиями. В эукариотических клетках после инициации транскрипции происходит модификация 5′-трифосфата в образующейся цепи за счет присоединения так называемого кэпа – метилированного остатка гуанозина. Кроме того, у большинства транскриптов происходит также модификация 3′-концов — по окончании транскрипции к ним присоединяется цепочка из остатков аденина, образующая характерный ро1уА-«хвост» (исключением из этого правила являются мРНК гистонных белков). У всех эукариот при транскрипции ДНК образуются молекулы РНК трех вышеназванных классов. Все они участвуют в процессе трансляции — третьей разновидности матричных процессов передачи информации — от РНК к белку.
49. Асимметричность транскрипции
3.Униполярность. 4.Беззатравочностъ. 5.Асимметричность.
В качестве матрицы используется одна цепь ДНК. Не совсем ясно, как ферментная система осуществляет правильный выбор нужной цепи. Видимо, ключевую роль играют какие-то последовательности нуклеотидов на одной из цепей, узнаваемые системой.
50. РНК-полимеразы эукариотических организмов
Транскрипционный аппарат эукариотических клеток устроен значительно сложнее и изучен хуже, чем бактериальный. У эукариот обнаружены 3 ядерные РНК-полимеразы, отличающиеся разной локализацией в ядре и состоящие из большого числа субьединиц. Кроме того, в митохондриях и хлоропластах эукариотических клеток имеются свои собственные РНК-полимеразы.
Основная часть полимеразной активности приходится на долю РНК Pol І, которая обнаруживается в ядрышках и ответственна за транскрипцию генов рРНК. На долю этого фермента приходится 50-70% клеточного синтеза РНК и эта РНК-полимераза стимулируется в равной степени ионами Mn 2+ и Mg 2+
Другим важным ферментом является РНК Pol ІІ. Она локализована в нуклеоплазме (всё ядро за исключением ядрышка). Этот фермент синтезирует 20-40% всех молекул РНК в клетке и ответственен за синтез гетерогенныхядерных РНК (гяРНК), которые являются предшественниками иРНК. Эта РНК-полимераза намного сильнее стимулируется ионами Mn 2+ , чем ионами Mg 2+ .
РНК Pol ІІІ представляет собой минорную ферментативную активность, обеспечивающую 10% клеточного синтеза РНК, локализована в нуклеоплазме и осуществляет синтез малых ядерных РНК (мяРНК) и тРНК.
РНК-полимеразы эукариот имеют большую молекулярную массу и представляют собой комплекс мультимерных белков (500 –700 кД). От 14 до 17 субъединиц в зависимости от типа полимеразы.
НК-полимеразы различаются количеством субьединиц, их аминокислотным составом, и зависимостью от катионом магния и марганца. Для РНК-полимераз І и ІІІ необходимое для работы соотношение [Mn 2+ ]/[Mg 2+ ]=2. Для РНК-полимеразы ІІ — [Mn 2+ ]/[Mg 2+ ]=5.
Наиболее яркое различие – чувствительность к α-аманитину(токсину бледной поганки). Он полностью подавляет работу РНК-полимеразы ІІ в концентрации 10 -8 М и РНК-полимеразы ІІІ (в концентрации 10 -6 М). РНК-полимераза І фактически не чувствительна к этому токсину.
Помимо ядерных РНК-полимераз у эукариот есть ещё РНК-полимеразы хлоропластов и митохондрий. Они кодируются в ядре, а не в соответствующих органеллах.
В органеллах образуются свои tРНК и rРНК и рибосомные белки.
51. РНК-полимеразы прокариот
Прокариоты содержат одну РНК-полимеразу.
РНК- полимераза Е.Coli – белок, имеющий четвертичную структуру. В клетке присутствует около 7000 молекул РНК-полимеазы.
Субьединичный состав РНК-полимеразы Е.Coli:
2 αββ’ σ ω – holo-фермент (полный фермент).
2αββ’ω – core-фермент (150×115×110 А).
Без σ -фактора это core-фермент. σ -фактор – сменный фактор специфичности(σ 70 , σ 28 , σ 54 и др.)
Две α-субьединицы – каркас РНК-полимеразы. К ним крепятся остальные субьединицы.
β’ — субьединица отвечает за прочное связывание с ДНК за счёт кластера положительно заряженных аминокислот.
β – в субьединице находятся два каталитических центра. Один отвечает за инициацию, а другой – за элонгацию РНК-цепи. Один центр работает в holo-, а другой в core-ферменте.
Для элонгации необходим комплекс α2ββ’, а для инициации к нему должна быть присоединена σ−субъединица. σ−субъединицы различаются в зависимости от того, какую группу промоторов должна узнавать РНК-полимераза. После инициации σ−субъединица диссоциирует и к элонгирующей РНК-полимеразе могут присоединяться ассоциированные факторы. Когда РНК-полимераза доходит до терминатора транскрипции, синтез РНК останавливается, РНК-полимераза и синтезированная РНК диссоциируют.
Кор-фермент α2ββ’ω обладает полимеризующей активностью.
σ-фактор обеспечивает узнавание промотора и инициацию.
Полный фермент- холофермент (Mg 2+ ) α2ββ’ω σ.
52. Строение РНК-полимеразы прокариотических организмов
РНК-полимераза бактерий сосотоит из 5 субьединиц – (кор-фермент)
2αββ’ω+ σ-фактор (полный holo-фермент).
У прокариот имеется 2 типа РНК-полимеразы: одна из них синтезирует РНК-затравки для фрагментов Оказаки, а другая — все остальные типы РНК.
Синтез РНК (транскрипция) осуществляется ферментами ДНК-зависимыми РНК-полимеразами. РНК-полимеразы используют в качестве субстратов нуклеозидтрифосфаты и активны только в присутствии ионов Mg 2+ . РНК-полимеразы не нуждаются в праймере. Бактериальные РНК-полимеразы – сложные белки, состоящие из нескольких субъединиц. Наиболее изученный фермент кишечной палочки содержит 5 субъдиниц: две субъединицы α и по одной β, β´, ώ (основа фермента – кор). После присоединения к кору еще одной субъединицы – σ-фактора – образуется холофермент РНК-полимераза. Функцией холофермента РНК-полимеразы является связывание с промотором и инициация транскрипции. Кор-фермент (α,α,β,β´) осуществляет элонгацию, т.е. собственно синтез РНК.
53. Структура промоторов прокариотических организмов
Прокариотические промоторы варьируют в размерах–от 20 до 200п.н., но наиболее типичным является промотор, величиной 40п.н.
Промотор — это участок ДНК, ответственный за связывание с РНК-полимеразой. В случае прокариот, наиболее важными для регуляции транскрипции являются последовательности, обозначаемые «—35» и «— 10». Нуклеотиды, расположенные до инициирующего кодона («вверх по течению») записываются со знаком «-», а со знаком «+» — все нуклеотиды, начиная с первого в инициирующем кодоне (стартовая точка). Направление, в котором продвигается процесс транскрипции, называется «вниз по течению». Последовательность, обозначаемая «-35» (TTGACA), отвечает за узнавание промотора РНК-полимеразой, а последовательность «-10» (или бокс Прибнова) является тем участком, с которого начинается раскручивание двойной спирали ДНК. В состав этого бокса наиболее часто входят основания ТАТААТ. Такая последовательность оснований чаще всего встречается в промоторах прокариот, ее называют консенсусной. В состав ТАТА-бокса входят аденин и тимин, между которыми имеются только две водородные связи, что облегчает расплетание цепей ДНК в этом районе промотора. В случае замен пар оснований в указанных последовательностях промотора нарушается эффективность и правильное определение точки начала транскрипции, с которой фермент РНК-полимераза начинает синтез РНК. Когда благодаря действию специфических регуляторных элементов уровень экспрессии генов возрастает, регуляция называется позитивной. Позитивная регуляция может осуществляться путем связывания специфических белков с нуклеотидными последовательностями, расположенными в области промотора. Считается, что связанный активаторный белок способствует ассоциации РНК-полимеразы с промотором и, следовательно, увеличивает вероятность инициации транскрипции.
54. Строение мРНК эукариот
Эукариотические мРНК довольно стабильны. Период их полураспада измеряется часами и даже сутками. Эукариотические мРНК синтезируются в виде предшественников и проходят в своем биогенезе стадию довольно сложного созревания, или процессинга.
Каждая мРНК содержит информацию о составе той или иной полипептидной цепи, количество разных мРНК в клетке очень велико. линейная цепь мРНК содержит несколько областей с различной функциональной ролью:
а) На 5′-конце находится КЭП (участок из 1-4 модифицированных нуклеотидов). Такая стр-ра защищает 5‘-конец мРНК от экзонуклеаз.
б)У эукариот за «колпачком»(КЭП) идет 5′-нетранслируемый участок — последовательность из нескольких десятков нуклеотидов. Она комплементарна одному из отделов той рРНК, которая входит в малую субъединицу рибосомы. За счет этого она служит для первичного связывания мРНК с рибосомой,но сама не транслируется.
в) Трансляция мРНК начинается всегда с инициирующего кодона. Во всех мРНК он всегда один и тот же — АУГ,т. е. кодирует метионин. Поэтому после синтеза
пептидной цепи с ее N-конца,отщепляется метионин (если последний не нужен для функционирования белка).
г) За инициирующим кодоном в мРНК следует кодирующая часть, которая, содержит информацию о последоват-ти АК в белке.
У эукариот зрелые мРНК являются моноцистронными т. е. каждая из них несет информацию о структуре только одной полипептидной цепи. иногда пептидная цепь вскоре после образования на рибосоме разрезается на несколько более мелких цепей. У эукариот кодирующая часть зрелой мРНК лишена интронов — каких-либо вставочных некодирующих последовательностей.
д) По окончании кодирующего участка имеется кодон терминации — один из трех кодонов: УАА, УАГ или УГА.
е) За этим кодоном м.следовать еще 3′-нетранслируемый участок, значит.превышающий по длине 5′-нетранслируемую область.
ж)почти все зрелые мРНК эукар(кроме гистоновых мРНК)на З’-конце содержат поли(А)-фрагмент из 150-200 адениловых нуклеотидов.
И З’-нетранслируемый участок, и поли(А)-фрагмент имеют отношение к регуляции продолжительности жизни мРНК, поскольку разрушение мРНК осуществляется 3-экзонуклеазами.
В клетках молекулы мРНК практически всегда связаны с белками. Последние, стабилизируют линейную структуру мРНК, т. е. предупреждают образование в кодирующей части «шпилек». белки могут защищать мРНК от преждевременного разрушения. Такие комплексы мРНК с белками иногда называют информосомами.
55. Узнавание промотора в процессе транскрипции
Механизм транскрипции 4 этапа:
1.Узнавание промотора 2. Инициация
Инициация транскрипции происходит на специфическом участке ДНК, называемом промотором. Для узнавания промотора необходим σ−фактор, причем различные σ−факторы отвечают за узнавание различных классов промоторов. Как правило узнаются блоки, отстоящие на 10 и 35 нуклеотидов от точки начала транскрипции. Затем присоединяется РНК-полимераза, представляющая собой тетрамер из субьединиц трёх видов: α, β, β’. В некоторых оперонах,например в лактозном, необходимо ещё предварительное взаимодействие с промотором дополнительного белка (CAP).
У эукариот всегда требуется предварительное связывание с промоторм целой совокупности белков – общих факторов транскрипции, с образование комплекса TFIID
Различие между прокариотической и эукариотической транскрипцией
Прокариотическая транскрипция происходит в цитоплазме клетки, а у прокариот транскрипция и трансляция происходят одновременно. Эукариотическая транскрипция происходит в ядре клетки, а у эукариот тран
Содержание:
- Основное отличие — прокариотическая и эукариотическая транскрипция
- Что такое прокариотическая транскрипция
- Что такое эукариотическая транскрипция
- Различие между прокариотической и эукариотической транскрипцией
Основное отличие — прокариотическая и эукариотическая транскрипция
Прокариотическая транскрипция происходит в цитоплазме клетки, а у прокариот транскрипция и трансляция происходят одновременно. Эукариотическая транскрипция происходит в ядре клетки, а у эукариот транскрипция и трансляция различаются по пространству и времени.
Прежде чем подробно узнать разницу между прокариотической и эукариотической транскрипцией, давайте сначала рассмотрим процесс транскрипции. Транскрипция — это процесс создания молекулы РНК с использованием одной из цепей ДНК в качестве матрицы. Здесь информация в ДНК транскрибируется или копируется в молекулу мессенджер РНК (мРНК). Затем эта мРНК транспортируется в цитоплазму, где она переводится в функциональную молекулу белка с помощью многочисленных ферментов.
Транскрипция требует трех основных компонентов:
ДНК-матрица (шаблонная цепь) — для транскрипции используется только одна цепь молекулы ДНК.
Сырье, такое как рибонуклеозидтрифосфат (rNTPs)
Транскрипционный аппарат — ферменты, необходимые для запуска и продолжающегося процесса транскрипции
Процесс транскрипции состоит из трех этапов; начало, удлинение и прекращение.
инициирование — аппарат транскрипции собирается на промоторе и запускает синтез РНК.
относительное удлинение — РНК-полимераза считывает матричную цепь ДНК, разматывая ДНК двойной спирали и добавляя новые нуклеотиды, по одному, к 3′-концу синтезирующей цепи РНК.
прекращение — распознавание конца транскрипционной единицы и отделение молекулы РНК от матрицы ДНК.
Что такое прокариотическая транскрипция
У прокариот нет организованного ядра, поэтому ядерные материалы или ДНК находятся в цитоплазме. Следовательно, транскрипция происходит в цитоплазме, и все предшественники, необходимые для транскрипции, обнаруживаются в цитоплазме. Прокариотическая транскрипция требует фермента РНК-полимеразы для успешного завершения транскрипции. Фермент содержит пять субъединиц (α, β, β ’, ω) и связывается с сигма-фактором и областью промотора, а затем инициирует транскрипцию, завершая голофермент. У прокариот ДНК не связана с гистонами. Таким образом, транскрипция инициируется напрямую. Это может быть выгодно, когда прокариоты имеют перекрывающиеся гены. Транскрипция начинается в области промотора и удлиняется через кодирующую область и заканчивается, когда РНК-полимераза считывает сигнал терминации. Существует два типа сигналов завершения: Rho-зависимый и независимый. Транскрибированная мРНК будет полностью транслирована во время транскрипции, и большую часть времени пост-транскрипционная обработка не будет проходить.
Типичная прокариотическая клетка
Что такое эукариотическая транскрипция
Эукариотическая транскрипция является более сложной, чем эукариотическая транскрипция, и происходит внутри ядра. В отличие от прокариот, эукариоты содержат пять типов РНК-полимераз в зависимости от необходимости транскрипции и содержат 10-17 субъединиц. Например, РНК-полимераза I транскрибирует большую мРНК, а РНК-полимераза II транскрибирует snRNA, snoRNA и miRNA и т. Д. Эти пять ферментов по-разному обнаруживаются в организмах, например, РНК-полимераза IV и V присутствуют только в растениях.
Транскрибирование молекул
PreMRNA, некоторые snRNAs, snoRNAs, некоторые miRNAs
Молекулярная биология. Транскрипция у эукариот.
1. РНК-полимеразы эукариот
Как мы помним, эукариоты — организмы имеющие оформленное ядро. Процесс транскрипции у эукариот по смыслу не отличается от прокариот, однако каждая из стадий обрастает все новыми подробностями.
Начнем с обзора эукариотических РНК-полимераз. Если в клетках бактерий все гены транскрибировала одна полимераза, то у эукариот существует, как минимум 3 типа РНК-полимераз, работающих в ядре:
1) РНК-полимераза типа I — синтезирует предшественницу рибосомальных РНК (рРНК), входящих в состав рибосомы
2) РНК-полимераза типа II — самая изученная полимераза, отвечает за синтез мРНК белков и малых ядерных РНК
3) РНК-полимераза III — синтезирующая тРНК, 5S рРНК и другие малые РНК, присутствующее в ядре и цитозоле.
Остальные РНК-полимеразы, работающие в митохондриях и хлоропластах. Например, РНК-пол IV – синтезирует siРНК в семенах растений, которая метилирует гены 5S; РНК-пол V – синтезирует РНК, которая вовлекается в siРНК-направленное формирование гетерохроматина у растений, а так же митохондриальная РНК-пол – 2 СЕ у дрожжей (145 и 43 кДа) и 1 СЕ у высших эукариотов ( 140 кДа)
Все РНК-полимеразы эукариот это мультисубъединичные белковые комплексы, с большой молекулярной массой. Гигантские машины для синтеза РНК.
2. РНК-полимераза II
Как отмечалось ранее, РНК-полимераза II является наиболее изученной полимеразой, а в 2006 году Роджер Корнберг был удостоен Нобелевской премии по химии за исследование механизма копирования клетками генетической информации, в частности за установление соотношения атомов в РНК-полимеразе эукариотов.
Как оказалось, эукариотические РНК полимеразы не способны сами по себе инициировать транскрипцию. Для этого им необходимы вспомогательные белки — факторы инициации, формирующие совместно с полимеразами преинициаторные комплексы.
В состав РНК-полимераз входят: самые большие СЕ (135 и 195 кДа) гомологичны СЕ бэта и бэта’ бактерий, они формируют активный центр, 35-кДа СЕ – аналог альфа-СЕ бактериальной РНК-полимеразы, а так же некоторые другие СЕ отдаленно напоминающие СЕ бактериальных полимераз.
Теперь, чтобы начать транскрипцию необходимо наличие вспомогательных белков, которые называются транскрипционные факторы. Вначале с промотором взаимодействуют общие для всех генов класса II факторы транскрипции, они подготавливают промотор для связывания РНК-пол II. В результате формируется базальная машина транскрипции генов класса II — PIC.
Пока вы можете оценить всю мощь комплекса РНК-полимеразы и различных факторов транскрипции по видео (может немного рановато, но вдохновляюще)
3. Эукариотические промоторы
Я думаю сейчас самое время поговорить о промоторах. Как мы помним из прошлых постов, у прокариот промотор выглядел просто и состоял из двух блоков. Тут же дела обстоят несколько сложнее. Вообще для регуляции экспрессии генов существуют:
Цис-элемент (цис-действующий сайт, цис-регуляторный элемент) – последовательность ДНК, влияющая на транскрипцию гена, к которому она принадлежит территориально (на той же молекуле ДНК). Может располагаться в промоторе, в интронах и за кодирующей частью гена. Как правило, не транскрибируется
Транс-факторы (транс-действующий сайт) – последовательности ДНК, кодирующие белки, изменяющие активность генов, расположенных в любом месте генома. Эти последовательности транскрибируются и транслируются – транскрипционные факторы
Главными (коровыми) элементами промоторов генов класса II являются:
ТАТА-блок -25 п.н. с 5′-стороны от точки +1 — ТАТААА (это вполне объяснимая последовательность, т.к. между нуклеотидами А и Т образуются 2 водородные связи, и нити с такими последовательностями куда проще разъединить, чем пары Г и Ц с 3мя водородными связями)
Инициаторный (Inr) элемент располагается вокруг стартовой точки транскрипции
sINR – более консервативен и дополнительно имеет консервативные фланкирующие последовательности
Любого из них достаточно для правильной инициации транскрипции in vitro
Промоторы для РНК-полимеразы II могут включать в себя разное количество элементов:
1) ТАТА-бокс и Inr (очень сильный промотор)
2) Inr- последовательность и отсутствие ТАТА-бокса (ТАТА-less)
3) ТАТА-бокс
Если вы расслабились и подумали, что это всё, вынуждена вас огорчить.
С промоторами встречаются:
DCE – расположен по ходу транскрипции и состоит из трех субэлементов: SI (CTTC) располагается +6 — +11, SII (CTGT) располагается +16 — +21, SIII (AGC) – от +30 до +34
Цис-элемент В – участок ДНК, узнающий TFIIB — BREu и BREd (G/C G/C G/A C G C C), элементы, фланкирующие ТАТА-боксом, работают только с ТАТА-боксом
DPE – элемент промотора, расположенный по ходу транскрипции A/gGA/tC/tG/a,c (+28 — +32), характерен для промоторов, потерявших ТАТА-бокс
XCPE1 (10 п.н. -8 +2, пурины) и ХСРЕ2 (11 п.н., пиримидины), найдены в промоторе гена Х вируса гепатита В, у человека 1% генов содержит эти элементы
UAS – элементы, усиливающие промотор: GC-бокс (GGGCGCC) и/или СААТ-бокс (GGCCAATCT), находятся слева от точки +1, на расстоянии примерно 300 пар нуклеотидов.
и многие другие. поэтому промотор теперь становится длиной от 100 до 1000 пар нуклеотидов.
Некоторые комбинации промоторов:
Наличие различных по виду промоторов является необходимым условием для жизнедеятельности клетки. С помощью различных вариаций элементов достигается контроль над экспрессией генов. Есть некоторые наблюдения, например: наличие различных элементов влияет не только на скорость транскрипции, но и трансляции; существует связь между типом корового промотора и длиной гена: гены, имеющие ТАТА-промоторы, в три раза короче генов, потерявших ТАТА-бокс; укорочение гена связано с укорочением длины интронов.
Так же к важнейшим цис-элементам можно добавить:
Энхансеры – регуляторные последовательности ДНК, расположенные на расстоянии тысяч пар нуклеотидов справа или слева от точки старта и усиливающие транскрипцию регулируемого гена.
Сайленсеры — регуляторные последовательности ДНК, расположенные на расстоянии тысяч пар нуклеотидов справа или слева от точки старта и ослабляющие транскрипцию регулирумого гена.
Таким образом, сборка инициирующего комплекса транскрипции у эукариот не ограничивается одним промотором, а включает в себя элементы, находящиеся на расстоянии тысячи пар нуклеотидов от регулируемого гена.
На рисунке изображен преинициирующий комплекс РНК-полимеразы, вы можете оценить его сложность:
в следующем посте я планирую рассказать о том, как именно собирается преинициирующий комплекс РНК-полимеразы. Спасибо за внимание!
5.7K поста • 65.3K подписчика
Основные условия публикации
— Посты должны иметь отношение к науке, актуальным открытиям или жизни научного сообщества и.
Транскрипция
Транскрипция — процесс синтеза РНК с использованием ДНК в качестве матрицы, происходящий во всех живых клетках. Другими словами, это перенос генетической информации с ДНК на РНК.
В процессе транскрипции генов происходит биосинтез молекул РНК, комплементарных одной из цепей матричной ДНК, сопровождаемый полимеризацией четырех рибонуклеозидтрифосфатов (ATP, GTP, CTP и UTP) с образованием 3’–5′-фосфодиэфирных связей и освобождением неорганического пирофосфата.
Транскрипция катализируется ферментом ДНК-зависимой РНК-полимеразой. Процесс синтеза РНК протекает в направлении от 5′- к 3′- концу, то есть по матричной цепи ДНК РНК-полимераза движется в направлении 3′->5′
РНК-полимеразы могут состоять из одной или нескальких субъединиц. У митохондрий и некоторых бактериофагов, например SP6, T7 с небольшим числом генов простых геномов, где отсутствует сложная регуляция РНК-полимераза состоит из одной субъединицы. Для бактерий и эукариот, с большим числом генов и сложными системами регуляции РНК-полимеразы состоят из нескольких субъединиц. Показано, что фаговые РНК-полимеразы состоящие из одной субъединицы могут взаиодействовать с белками бактерий, которые меняют их свойства [Патрушев, 2000].
У прокариот синтез всех видов РНК осуществляется одним и тем же ферментом.
У эукариот — 3 ядерные РНК-полимеразы, митохондриальные РНК-полимеразы, хлоропластные РНК-полимеразы.
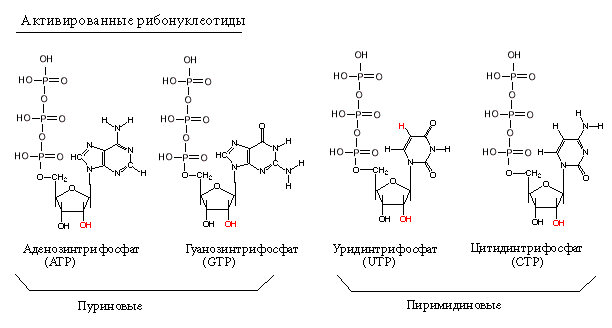
Субстратами для РНК-полимераз служат рибонуклеозид-трифосфаты (активированные нуклеотиды). Весь процесс транскрипции осуществляется за счет энергии макроэргических связей актвированных нуклеотидов.
Первый нуклеотид в РНК всегда пурин в форме трифосфата.
Факторы транскрипции — белки взаимодействующие с друг другом, регуляторными участками ДНК и РНК-полимеразой с образованием транскрипционного комплекса и регулирующие транскрипцию. Благодаря факторам транскрипции и регуляторным последовательностям генов становится возможным специфический синтез РНК.
Принципы транскрипции
комплиментарность — mRNA комплиментарна матричной цепи ДНК и аналогична кодирующей цепи ДНК
антипараллельность
униполярность
беззатравочность — РНК-полимераза не требует праймера
асимметричность
Стадии транскрипции
- распознавание промотора и связывание — РНК-полимераза связывается с ТАТА-боксом 3’-промотора при помощи основных факторов транскрипции, дополнительные факторы ингибируют или стимулируют присоединение
- инициация — образование первой фосфодиэфирной связи между Pu и первым нуклеотидом. К пуринтрифосфату присоед нуклеотид комплиментарный второму нуклеотиду ДНК с отщеплением пирофосфата от нуклеозидтрифосфата с образ диэфирной связи
- элонгация ( 3’→5’)- мРНК гомологичная нематричной (кодирующей, смысловой) ДНК, синтезируется на матричной ДНК; какая из двух цепей ДНК будет матрицей, определяется направлением промотора
- терминация
Транскрипционные фабрики
Существует ряд экспериментальных данных, свидетельствующих о том, что транскрипция осуществляется в так называемых транскрипционных фабриках: огромных, по некоторым оценкам, до 10 МДа комплексах, которые содержат около 8 РНК-полимераз II и компоненты последующего процессинга и сплайсинга, а также пруф-ридинга новосинтезированного транскрипта. В ядре клетки происходит постоянный обмен между пулами растворимой и задействованной РНК-полимеразы. Активная РНК-полимераза задействована в таком комплексе, который в свою очередь является структурной организовывающей компактизацию хроматина единицей. Последние данные. свидетельствуют о том, что транскрипционные фабрики существуют и в отсутствие транскрипции, они фиксированы в клетке (пока не ясно, взаимодействуют ли они с матриксом клетки или нет) и представляют собой независимый ядерный субкомпартмент. Попытки выделить белковый функциональный комплекс транскрипционной фабрики пока не привели к успеху ввиду его огромных размеров и низкой растворимости.
Транскрипция у эукариот
РНК-полимеразы эукариот
У эукариот имеется 3 типа РНК-полимераз (не считая митохондриальной и хлоропластной):
РНК полимеразаI — синтезирует в ядрышках рибосомные RNA (18S и 28S рРНК, кроме 5S);
РНК-полимеразаII — синтезирует mRNA и некоторых sRNA;
РНК-полимеразаIII — синтезирует tRNA, sRNA, 5S rRNA.
RNA-полимеразы эукариот отличаются: количеством субъединиц – 2 большие (120-220кДа) и до 8 малых (10-100кДа), потребностью в ионах Mg и Mn, чувствительностью к – амонитину — токсину бледной поганки — пептиду включающему D-аминокислоты: polI — устойчива, polII — ингибируется при концентрации 10-8М, polIII — при 10-6М амонитина. РНК-полимеразы I,II,III кодируются в ядре. Большие субъединицы гомологичны β и β`-субъединицам эубактерий.
РНК-полимераза I
РНК-полимераза II
PolII Человека содержит более 10 субъединиц, слабо ассоциирующих друг с другом. Некоторые из них принадлежат к основным факторам транскрипции (GTF).
Белки holo-фермента PolII дрожжей [Патрушев, 2000].
Pol II — РНК-Полимеразная активность, взаимодействует с множеством общих и тканеспецифических факторов транскрипции, участвует в выборе точки инициации транскрипции.
TFIIB — Связывает Pol II и TBP на промоторе, участвует в выборе точки инициации транскрипции
TFIIF — Взаимодействует с Pol II, стимулирует элонгацию транскрипции Pol II, компонент субкомплекса SRB/медиатор
TFIIH — Активность ДНК-зависимой ATPазы, ДНК-геликазная активность, обладает активностью CTD-киназы
SRB2, SRB5 — Участвуют в образовании инициационного комплекса, стимулируют базальный и индуцированный синтез РНК,
взаимодействуют с TBP, компоненты субкомплекса SRB/медиатор
GAL11/SPT13 — Участвуют в образовании инициационного комплекса, стимулируют базальный и индуцированный синтез РНК,
компоненты субкомплекса SRB/медиатор, предположительно взаимодействуют с активаторами транскрипции
SUG1 — Компонент субкомплекса SRB/медиатор, предположительно взаимодействует с активаторами транскрипции
SRB4, SRB6, SRB7, SRB8, SRB9, SRB10, SRB11 — Компоненты субкомплекса SRB/медиатор, предположительно
взаимодействуют с CTD-доменом Pol II
РНК-полимераза III
Факторы транскрипции
Инициация
Инициация транскрипции происходит на кэп-сайте кодирующем первый нуклеодид первого экзона мРНК.
ТАТА-бокс локализуется в 25-30 пн выше кэп-сайта связывая РНК-полимеразу перед кэп-сайтом. Промотор — примерно 200 пн выше кэп-сайта. Энхансеры обычно имеют длину 100-200 пн.
Элонгация
Терминация
Терминация на сайте полиаденилирования.
Вновь синтезированная РНК генов связывается с ядерными белками — информомерами, подвергается различным посттранскрипционным модификациям и транспортируется из ядра (см. обзор Процессинг) для последующей трансляции (см. обзор Трансляция).
Транскрипция у прокариот
РНК-полимераза E.coli
РНК-полимераза E.coli осуществляет транскрипцию всех бактериальных генов и состоит из нескольких субъединиц: α-35кДа, β‘-165кДа, β-155кДа, σ-чаще 70кДа (σ70). РНК-полимераза состава ααββ’σ70 называется holo-фермент (Еσ70), состава ααββ’- core-фермент (E).
σ — сменный фактор специфичности, который диссоциирует после инициации транскрипции. Элонгация и терминация осуществляется core-ферментом. У Е.coli
10 видов σ-субъединиц. Транскрипция генов теплового шока, оперонов gln или nif осуществляется σ54 в составе holo-фермента Eσ54 (54 кДа).
Все субъединицы заряжены отрицательно: σ>α>β>β’ – расположены по убыванию заряда. В каждой субъединице имеется кластер (+)-заряженных участков, которыми они связываются с ДНК. Наибольшее число кластеров у – β’, который участвует в связывании фермента с ДНК, β-субъединица содержит активные центры — инициации и элонгации, α-субъединицы обеспечивают правильное взаимодействие фермента с промоторами. Рифампицин – блокирует инициацию, стрептолидигин – блокирует элонгацию, что говорит о разнесении активных центров в РНК-полимеразе.
Узнавание и связывание RNA-pol с промотором осуществляется holo-ферментом
Одновременно в клетке присутствует около 7000 молекул РНК-полимеразы. Только holo-фермент обладает высоким сродством к специфической последовательности нуклеотидов — промотору, сродство к остальным случайным последовательностям ДНК у него снижено в 10000 раз. У core-фермента одинаковое сродство к любой последовательности нуклеотидов.
Сам по себе сигма — фактор обладает наименьшим сродством к ДНК по сравнению с другими субьединицами РНК-полимеразы, однако он придает holo-ферменту такую конформацию, которая обладает повышенным сродством к промотору.
Стадии узнавания и связывания, а также инициации осуществляются holo-ферментом. Элонгация и терминация осуществляются core-ферментом.
Две α субъединицы — каркас РНК-полимеразы. К ним крепятся остальные субъединицы.
β’ — субъединица отвечает за прочное связывание с ДНК за счет кластера положительно заряженных аминокислот.
В β — субъединице находятся два каталитических центра. Один отвечает за инициацию, а другой — за элонгацию. Один центр работает в holo-, а другой — в core- ферменте.
Инициация транскрипции
РНК-полимераза Ecoli узнает два 6н разделенных 25н
Элонгация транскрипции
Терминация транскрипции
Регуляция транскрипции
Схема негативной индукции Жакоба и Моно
Lac-оперон E. coli содержит 3 гена, отвечающие за образование белков, участвующих в переносе в клетку дисахарида лактозы и в ее расщеплении.
Z-β — галактозидаза (расщепляет лактозу на глюкозу и галактозу).
Y-β- галактозидпермеаза (переносит лактозу через мембрану клетки).
А — тиогалактозидтрансацетилаза (ацетилирует галактозу).
В отсутствие в клетке лактозы lac-оперон выключен. Активный белок — репрессор, кодируемый в моноцистронном опероне (LacI) , не имеющем оператора, связан с оператором lac-оперона. Поскольку оператор перекрывается с промотором, даже посадка РНК-полимеразы на промотор невозможна.
Как только некоторое количество лактозы попадает в клетку, две молекулы субстрата (лактозы) взаимодействуют с белком — репрессором, изменяют его конформацию — и он теряеет сродство к оператору.
Тут же начинается транскрипция lac-оперона и трансляция образующейся mРНК; три синтезируемых белка участвуют в утилизации лактозы.
Когда вся лактоза переработана, очередная порция репрессора, свободного от лактозы, выключает lac-оперон.
Схема позитивной индукции
Когда в клетку попадает арабиноза, она взаимодействует с белком — репрессором. Белок — репрессор меняет конформацию и превращается из репрессора в активатор, взаимодейсивующий с промотором и облегчающий посадку РНК-полимеразы на промотор.
Эта схема регуляции называется позитивной индукцией, поскольку контролирующий элемент — белок — активатор «включает» работу оперона.
Схема позитивной репрессии
В опероне синтеза рибофлавина у Вacilus subtilis располагаются цистроны ферментов синтеза рибофлавина. Есть белок-активатор, обеспечивающий посадку РНК-полимеразы на промотор. В норме оперон открыт. Образуется N молекул рибофлавина.
N+1-ая молекула (лишняя) взаимодействует с активатором и он теряет способность активировать посадку РНК-полимеразы на промотор.
Позитивная репрессия, поскольку в регуляции участвует белок — активатор, а сама регуляция заключается в выключении транскрипции.
Схема негативной репрессии
В опероне синтеза триптофана у E. сoli имеется 5 цистронов, которые кодируют ферменты последовательной цепи реакций синтеза триптофана. В норме оперон включен. Белок — репрессор неактивен (в форме апо-репрессора), он не способен садиться на оператор.
Клетке нужно N молекул триптофана. N+1-ая молекула взаимодействует с апо-репрессором. Он меняет конформацию, садится на оператор и синтез РНК прекращается.
Схема регуляции — негативная репрессия, потому что белок репрессор «выключает» оперон.
Позитивный контроль работы lac-оперона
Lac-оперон, подчиняющийся схеме негативной индукции, имеет и позитивный контроль. цАМФ образуется из АТФ ферментом аденилатциклазой. Фосфодиэстераза превращает цАМФ в АМФ. Глюкоза активирует второй и инактивирует первый фермент. Чем больше в клетке глюкозы, тем меньше цАМФ.
Если нет глюкозы, то цАМФ соединяется с белком катаболической репрессии (САР) и образуется комплекс САР•цАМФ, активирующий посадку РНК-полимеразы на промотор. В присутствии лактозы lac-оперон включается и работает. Если же в клетке есть еще и глюкоза (более экономичный источнок энергии), то нет цАМФ — и активатор не образуется, lac-оперон работает слабо, без дополнительной индукции.
Транскрипция, особенности экспрессии генов у про- и эукариот
Транскрипция у про — и эукариот. Транскрипция — это синтез РНК на матрице ДНК. У прокариот синтез всех трех видов РНК катализируется одним сложным белковым комплексом — РНК-полимеразой.
Транскрипционный аппарат эукариотических клеток включает три ядерные РНК-полимеразы, а также РНК-полимеразы митохондрий и пластид. РНК-полимераза I обнаруживается в ядрышках клеток и отвечает за транскрипцию генов рРНК. РНК-полимераза II локализуется в ядерном соке и отвечает за синтез предшественника мРНК. РНК-полимераза III — небольшая фракция, находящаяся в ядерном соке и осуществляющая синтез малых рРНК и тРНК. Каждый из этих ферментов имеет две большие субъединицы и до 10 малых. РНК-полимеразы митохондрий и пластид отличаются от ядерных.
Ферментный комплекс РНК-полимеразы специфически узнает некую нуклеотидную последовательность (часто не одну), расположенную на определенном расстоянии от стартовой точки транскрипции, — промотор. Стартовой точкой считают нуклеотид ДНК, которому соответствует первый нуклеотид, включаемый ферментом в РНК-транскрипт.
У прокариот обычно недалеко от стартовой точки против хода транскрипции располагается последовательность из шести нуклеотидов -ТАТААТ, называемая блоком Прибнова. Это среднестатистическая последовательность, состоящая из наиболее часто встречаемых оснований, самыми консервативными из которых являются 1,2 и 6-е основания. Наличие в этой последовательности оснований, преимущественно соединенных двойными водородными связями с комплементарными основаниями другой цепи, очевидно, облегчает локальное плавление двойной спирали ДНК и образование двух ее одноцепочечных участков при контакте с РНК-полимеразой. Блок Прибнова располагается в положении от — 11 до — 5 или от — 14 до — 8, т.е. за несколько нуклеотидов перед стартовой точкой транскрипции (рис.36). Обнаруживая эту последовательность, РНК-полимераза прочно связывается с ней и начинает синтез РНК. Столь же важная роль в установлении контакта РНК-полимеразы с ДНК принадлежит другой нуклеотидной последовательности, центр которой находится в положении — 35. Ее называют областью узнавания — ТТГАЦА. Между двумя указанными участками расстояние достаточно постоянно и составляет от 16 до 19 пар нуклеотидов (п. н).
Промоторы эукариотических генов также включают по меньшей мере две специфические нуклеотидные последовательности, центры которых находятся в положении — 25 и — 75 п. н.
На расстоянии 19-27 нуклеотидов от стартовой точки против хода транскрипции у многих генов эукариот обнаружена среднестатистическая последовательность ТАТ А ТА А Т (ТАТА-блок, или блок Хогнесса), в которой, так же как в блоке Прибнова у прокариот, преобладают основания, образующие более слабые связи. Вторую последовательность, встречаемую во многих промоторах эукариот и состоящую из ГГ Ц ТЦААТЦТ, обозначают как ЦААТ-блок. Она занимает положение между — 70 и — 80 нуклеотидами и также является областью, узнаваемой полимеразой. В некоторых генах обнаружены многокомпонентные промоторы.
Так, в отдельных генах вируса герпеса для эффективной инициации транскрипции необходимы три последовательности ДНК, расположенные между — 19 и — 27, между — 47 и — 61, а также между — 80 и — 105 нуклеотидами.
В прокариотических клетках терминаторы обязательно содержат палиндромы — двухцепочечные последовательности нуклеотидов ДНК, которые одинаково читаются в обоих направлениях (рис.37). Участок РНК, транскрибированный с такой последовательности, способен образовывать двухцепочечные шпильки за счет комплементарного спаривания нуклеотидов палиндрома. Возможно, это и является сигналом для завершения транскрипции, узнаваемым РНК-полимеразой (рис.3.38). Возникающие шпильки, видимо, останавливают полимеразу на терминаторе. Следом за шпилькой в молекулу РНК включается последовательность из нуклеотидов, содержащих урацил (полиУ), которая, вероятно, принимает участие в высвобождении РНК от матрицы ДНК. Действительно, полиУ-последовательность РНК, соединенная с полиадениловой (полиА) последовательностью ДНК, характеризуется слабым взаимодействием. Обращает на себя внимание тот факт, что участок ДНК, богатый парами А-Т, встречается не только в месте инициации транскрипции (блок Прибнова), но и в терминаторной области.
Бактериальные терминаторы значительно различаются по своей эффективности. Некоторые из них как бы не замечаются РНК-полимеразой, и она продолжает транскрипцию за пределами терминатора. Такое прочитывание терминатора при транскрипции бактериальных генов наблюдается в результате предотвращения терминации специфическими белками — факторами антитерминации. Следствием антитерминации является синтез полицистронной мРНК, включающей в себя информацию, списанную с нескольких последовательно расположенных структурных генов.
Терминаторы эукарйогических генов изучены в меньшей степени, чем у проскариот, но в них также обнаружены районы, богатые Г-Ц парами, соединенными тройными водородными связями, в которых располагается, участок с А-Т парами. На этом участке в транскрипт включается полиУ-последовательность, слабо взаимодействующая с матричной полиА-областыо ДНК.
Возможно, область терминатора, богатая Г-Ц парами, играет определенную роль в остановке РНК-полимеразы, а участок РНК, содержащий УУУУ обеспечивает отделение транскрипта от матрицы ДНК.
У эукариот не обнаружено образования структур, подобных шпилькам в прокариотических РНК. Поэтому, каким образом у них осуществляется терминация транскрипции, остается неясным.
В составе всех мРНК можно выделить кодирующие участки, представляющие набор кодонов, которые шифруют последовательность аминокислот в пептиде. Как правило, эти участки начинаются стартовым кодоном АУГ, но иногда у бактерий используется кодон ГУТ. На конце кодирующей последовательности располагается терминирующий кодон. Помимо кодирующих участков в мРНК на обоих концах могут располагаться дополнительные последовательности. На 5′-конце это лидерный участок, расположенный перед стартовым кодоном. На 3′-конце -трейлер, следующий за кодоном-терминатором.
В связи с тем что прокариотические гены целиком состоят из нуклеотидных последовательностей, участвующих в кодировании информации, транскрибированные с них РНК сразу после их синтеза способны выполнять функцию матриц для трансляции. Лишь в исключительных случаях требуется их предварительное созревание — процессинг.
В отличие от прокариотических генов большинство генов эукариотических клеток прерывисты, так как несут в своем составе неинформативные нуклеотидные последовательности — интроны, не участвующие в кодировании информации. В связи с этим первичные транскрипты, синтезированные РНК-полимеразой II, обладают большими, чем необходимо для трансляции, размерами и оказываются менее стабильными. В совокупности они образуют так называемую гетерогенную ядерную РНК (тРНК), которая прежде чем выйти из ядра и начать активно функционировать в цитоплазме, подвергается процессингу и превращается в зрелые мРНК.
Процессинг эукариотических мРНК. Созревание, или процессинг, мРНК предполагает модифицирование первичного транскрипта и удаление из него некодирующих интронных участков с последующим соединением (сплайсингом) кодирующих последовательностей — экзонов. Модифицирование первичного транскрипта эукариотической мРНК начинается вскоре после синтеза его 5′-конца, содержащего одно из пуриновых оснований (аденин или гуанин). На этом конце образуется колпачок — кэп, который блокирует 5′-конец мРНК путем присоединения к первому нуклеотиду транскрипта трифосфонуклеозида, содержащего гуанин, связью 5′-5′.
После завершения транскрипции происходит удаление части нуклеотидов на 3′-конце первичного транскрипта и присоединение к нему последовательности, состоящей из 100-200 остатков адениловой кислоты (полиА) (рис.3.40). Считают, что эта последовательность способствует дальнейшему процессингу и транспорту зрелой мРНК из ядра. После выхода мРНК в цитоплазму ее полиА-последовательность постепенно укорачивается под действием ферментов, отщепляющих нуклеотиды на 3′-конце. Таким образом, по длине полиА-последовательности можно косвенно судить о времени пребывания мРНК в цитоплазме. Возможно, добавление полиА-последовательности в ходе процессинга повышает стабильность мРНК. Однако около трети мРНК вообще не содержат полиА-участка. К ним относятся, например, гистоновые мРНК.
Образование кэпа на 5′-конце и полиА-последовательности на 3′-конце характерно только для процессинга РНК, синтезируемых РНК-полимеразой II. Кроме метилирования при формировании кэпов в мРНК высших эукариот происходит метилирование небольшой части внутренних нуклеотидов с частотой приблизительно одно на тысячу оснований мРНК.
Наряду с модифицированием мРНК эукариот процессинг предполагает удаление из первичных транскриптов неинформативных для данного белка интронных участков, размер которых варьирует от 100 до 10 000 нуклеотидов и более. На долю интронов приходится около 80%всей гяРНК. Удаление интронов с последующим соединением экзонных участков называют сплайсингом (рис.40).
Сплайсинг представляет собой механизм, который должен обеспечивать удаление из первичного транскрипта строго определенных интронных участков. Нарушение этого процесса может привести к сдвигу рамки считывания при трансляции и невозможности синтеза нормального пептида. Закономерность вырезания интронов, очевидно, обеспечивается благодаря наличию на их концах специфических нуклеотидных последовательностей, служащих сигналами для сплайсинга.
В настоящее время описано несколько вероятных механизмов сплайсинга, обеспечивающих точность этого процесса. Возможно, она достигается действием каких-то ферментов, специфически узнающих концевые участки интронов и катализирующих разрыв фосфодиэфирных связей на границе экзон — интрон, а затем образование связей между двумя экзонами.
Установлено активное участие в сплайсинге особых малых, ядерных РНК (мяРНК), образующих комплексы с белками (мяРНП). Очевидно, мяРНК своими нуклеотидными последовательностями комплементарно взаимодействуют с концевыми участками интронов, которые образуют при этом замкнутые петли. Расщепление РНК в устье интронной петли приводит к удалению неинформативной последовательности и соединению (сплайсингу) сближенных концов экзонов.
Обсуждается также автокаталитическая способность РНК-транскрипта к сплайсингу. Описанные способы сплайсинга свидетельствуют об отсутствии универсального механизма этого процесса, однако во всех случаях достигается точное удаление интронов с образованием определенной мРНК, обеспечивающей синтез необходимого клетке белка.
В настоящее время доказана возможность альтернативного (взаимоисключающего) сплайсинга, при котором из одного и того же первичного транскрипта могут удаляться разные нуклеотидные последовательности и образовываться разные зрелые мРНК. В результате одна и та же последовательность нуклеотидов ДНК может служить информацией для синтеза разных пептидов. Альтернативный сплайсинг, вероятно, очень характерен в системе генов иммуноглобулинов у млекопитающих, где он позволяет формировать на основе одного транскрипта мРНК для синтеза разных видов антител.
Благодаря преобразованиям, происходящим с РНК-транскриптом в ходе процессинга, зрелые мРНК эукариот характеризуются большей стабильностью по сравнению с прокариотическими мРНК.
По завершении процессинга зрелая мРНК проходит отбор перед выходом в цитоплазму, куда попадает всего 5% гяРНК. Остальная часть расщепляется, не покидая ядра.
Таким образом, преобразования первичных транскриптов эукариотических генов, обусловленные их экзонитронной организацией и необходимостью перехода мРНК из ядра в цитоплазму, определяют особенности реализации генетической информации в эукариотической клетке.
Трансляция у про — и эукариот. В прокариотических клетках процесс трансляции сопряжен с синтезом мРНК: они происходят практически одновременно. В значительной степени это связано с недолговечностью бактериальной мРНК, которая достаточно быстро подвергается распаду. Взаимосвязанность транскрипции и трансляции у бактерии проявляется в согласованности скоростей этих процессов. При 37°С транскрипция идет со скоростью 2500 нуклеотидов/мин (14 кодонов/с), а трансляция осуществляется со скоростью 15 аминокислот/с.
Трансляция у прокариот начинается вскоре после образования 5′-конца мРНК, раньше, чем заканчивается ее синтез. В результате вслед за РНК-полимеразой по мРНК движутся рибосомы, осуществляющие сборку пептидных цепей (рис.41). Через некоторое время после начала транскрипции (около 1 мин) и до завершения трансляции 3′-конца матрицы начинается деградация ее 5′-конца. Ввиду того что время жизни разных мРНК не одинаково, количество белка, синтезированного на разных матрицах, различно.
Одной из особенностей трансляции у прокариот является включение в пептидную цепь в качестве первой аминокислоты модифицированного метионина — формилметионина, с которого начинаются все вновь синтезированные пептиды. Даже в том случае, когда роль стартового кодона выполняет кодом ГУГ, в обычных условиях шифрующий валин, в первом положении пептида оказывается формилметионин. Стартовый кодон АУГ или ГУГ следует за лидерным участком, который экранируется рибосомой в момент инициации трансляции.
Соединение рибосомы с мРНК обусловлено комплементарным взаимодействием нуклеотидов одной из рРНК с нуклеотидной последовательностью лидера мРНК.
Эта последовательность (Шайна-Дальгарно) располагается на расстоянии 4-7 оснований перед кодоном АУГ и обнаруживается повсеместно в лидерных участках у прокариот.
При соединении 5′-конца мРНК с малой субчастицей рибосомы стартовый кодон обычно оказывается почти в середине экранированного рибосомой фрагмента мРНК, в области, соответствующей ее П-участку.
У эукариот трансляция осуществляется в цитоплазме, куда попадает из ядра зрелая мРНК. Копированный конец мРНК распознается малой субчастицей рибосомы, затем лидирующая последовательность, содержащая до 100 нуклеотидов, взаимодействует с рРНК. При этом стартовый кодон АУГ оказывается в недостроенном П-участке рибосомы. После присоединения к стартовому кодону аминоацил-тРНК, несущей метионин, происходит воссоединение двух субчастиц рибосомы и формируются ее А — и П-участки. Синтез белка в эукариотической клетке, осуществляемый на моноцистронной мРНК, завершается после прохождения рибосомой по всей мРНК, вплоть до узнавания ею кодона-терминатора, прекращающего образование пептидных связей.
Посттрансляционные преобразования белков. Синтезированные в ходе трансляции пептидные цепи на основе своей первичной структуры приобретают вторичную и третичную, а многие — и четвертичную организацию, образуемую несколькими пептидными цепями. В зависимости от функций, выполняемых белками, их аминокислотные последовательности могут претерпевать различные преобразования, формируя функционально активные молекулы белка.
Многие мембранные белки синтезируются в виде пребелков, имеющих на N-конце лидерную последовательность, которая обеспечивает himузнавание мембраны. Эта последовательность отщепляется при созревании и встраивании белка в мембрану. Секреторные белки также имеют наN-конце лидерную последовательность, которая обеспечивает их транспорт через мембрану. Некоторые белки сразу после трансляции несут дополнительные аминокислотные пропоследовательности, определяющие стабильность предшественников активных белков. При созревании белка они удаляются, обеспечивая переход неактивного пробелка в активный белок. Например, инсулин вначале синтезируется как препроинсулин. Во время секреции пре-последовательность отщепляется, а затем проинсулин подвергается модификации, при которой из него удаляется часть цепи и он превращается в зрелый инсулин.
Синтез белка является основой жизнедеятельности клетки. Для осуществления этого процесса в клетках всех без исключения организмов имеются специальные органеллы — рибосомы. Рибосомы представляют собойрибонуклеопротеидные комплексы, построенные из 2 субъединиц: большой и малой. Функция рибосом заключается в узнавании трёхбуквенных (трехнуклеотидных) кодонов мРНК, сопоставлении им соответствующих антикодонов тРНК, несущих аминокислоты, и присоединении этих аминокислот к растущей белковой цепи. Двигаясь вдоль молекулы мРНК, рибосома синтезирует белок в соответствии с информацией, заложенной в молекуле мРНК. [1]
Для узнавания аминокислот в клетке имеются специальные «адаптеры», молекулы транспортной РНК (тРНК). Эти молекулы, имеющие форму клеверного листа, имеют участок (антикодон), комплементарный кодону мРНК, а также другой участок, к которому присоединяется аминокислота, соответствующая этому кодону. Присоединение аминокислот к тРНК осуществляется в энерго-зависимой реакции ферментами аминоацил-тРНК-синтетазами, а получившаяся молекула называется аминоацил-тРНК. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью аминоацил-тРНК-синтетаз, присоединяющих аминокислоты строго к соответствующим им тРНК (например, кодону GGU будет соответствовать тРНК, содержащая антикодон CCA, а к этой тРНК будет присоединяться только аминокислота глицин).
Механизмы трансляции прокариот и эукариот существенно отличаются, поэтому многие вещества, подавляющие прокариотическую трансляцию, в значительно меньшей степени действуют на трансляцию высших организмов, что позволяет использовать их в медицинской практике как антибактериальные средства безопасные для организма млекопитающих.
Процесс трансляции разделяют на
· инициацию — узнавание рибосомой стартового кодона и начало синтеза.
· элонгацию — собственно синтез белка.
· терминацию — узнавание терминирующего кодона (стоп-кодона) и отделение продукта.
9.Гибридологический метод и изменения, внесенные в него Менделем;
Сущность гибридологического метода изучения наследственности состоит в том, что о генотипе организма судят по признакам его потомков, полученных при определенных скрещиваниях. Основы этого метода были заложены работами Г. Менделя. Мендель скрещивал между собой сорта гороха, различающиеся теми или иными признаками (формой и окраской семян, окраской цветков, высотой стебля и др.), а затем следил, как наследуются признаки того и другого родителя их потомками в первом, втором и последующих гибридных поколениях. Проделав эту работу на достаточно большом количестве растений, Г.Мендель смог установить очень важные статистические закономерности количественного соотношения гибридных растений, обладающих признаками того и другого исходного сорта.
Позднее аналогичные исследования были осуществлены очень многими генетиками на различных Менделем на горохе, имеют общебиологическое значение, так как подтверждаются на самых разнообразных объектах.